Las proteínas
- Alba Cutillas

- 10 nov 2019
- 10 Min. de lectura
Actualizado: 17 nov 2019
¡Hola de nuevo a todos! Hoy habláremos de las proteínas: conoceremos que son, cuáles son sus funciones, sus diferentes estructuras y de qué manera se clasifican.
Las proteínas son biomoléculas orgánicas formadas por aminoácidos. Los aminoacidos son compuestos orgánicos sencillos de bajo peso molecular. Están formados químicamente por carbono, hidrógeno, oxígeno y nitrógeno; y además están formados por varios grupos: un grupo carboxilo (-COOH), un grupo amino (-NH2) y una cadena lateral (- R). Se unen mediante un enlace covalente al C alfa. Y además son sólidos, solubles en agua, cristalizables, más o menos incoloros, punto de fusión elevado y con actividad óptica.
Existen 20 aminoácidos proteicos y 150 aminoácidos no proteicos. Podemos clasificarlos según su polaridad:
Hidrófobos: Ala, Val, Leu, Ile, Pro, Met, Phe y Trp.
Hidrofílicos (polares): Ser, Thr, Gln, Asn, Tyr, Cys, Gly.
Ácidos: Asp, Glu.
Básicos: Lys, Arg, His.
Además, los aminoácidos, presentan ciertas propiedades que hacen posible llevar acabo sus respectivas funciones. Los aminoácidos son sólidos, solubles en agua, cristalinos, más o menos incoloros, tienen un elevado punto de fusión (superior a 200ºC) y una actividad óptica (pueden ser dextrógiros o levógiros y pueden adoptar forma D o L).
Otra de sus propiedades es la de carácter anfótero, lo que hace posible la regulación del pH del medio captando o cediendo electrones (actuando como base o ácido). Esto ocurre gracias a que se alcanza el punto isoeléctrico, en el cual el pH es 7. Este punto se alcanza cuando el aminoácido se queda con una parte positiva (el -NH2 tiende a coger H+ = -NH3+) y una parte negativa (el -COOH pierde H+ = -COO-), al estar en contacto con el agua.
Por otro lado, existen una serie de aminoácidos los cuales nuestro organismo no puede sintetizar y por ello los debemos tomar en la dieta, estos son los aminoácidos esenciales:
Los aminoácidos forman cadenas, uniéndose entre si por un tipo de enlace denominado enlace peptídico. Este enlace tiene lugar entre el grupo carboxilo de un aminoácido y el grupo amino del siguiente aminoácido, perdiéndose una molécula de agua. Los grupos amino y carboxilo que quedan libres en los extremos, se llaman N-terminal (amino terminal) y C-terminal (carboxilo
terminal), respectivamente. Este enlace es además de ser covalente, es corto y tiene cierto carácter de doble enlace ya que los átomos, que están dispuestos en un mismo plano, no pueden girar libremente. Según el número de aminoácidos que presente un cadena pueden ser:
Dipéptidos: Unión de dos aminoácidos.
Tripéptidos: Unión de tres aminoácidos.
Oligopéptidos: Tiene menos de 50 aminoácidos.
Polipéptidos: Tiene más de 50 aminoácidos.
Las proteínas, además, se disponen en el espacio formando una estructura tridimensional, que puede tener hasta cuatro niveles de organización:
Estructura primaria: secuencia lineal de aminoácidos presente en todas las proteínas. Se caracteriza por su disposición en zigzag debida que en el enlace peptídico se disponen todos los átomos en un mismo plano, lo que produce una rotación de los aminoácidos sobre los carbonos alfa. Las respectivas cadenas laterales se disponen alternativamente hacia arriba o hacia abajo.
Estructura secundaria: disposición espacial adoptada por la estructura primaria, es el plegamiento que la cadena polipeptídica adopta gracias a la formación de puentes de hidrógeno entre sus átomos. De esta manera, la cadena es capaz de adoptar conformaciones de menor energía libre, y por tanto, más estables. Dentro de esta hay tres tipos:
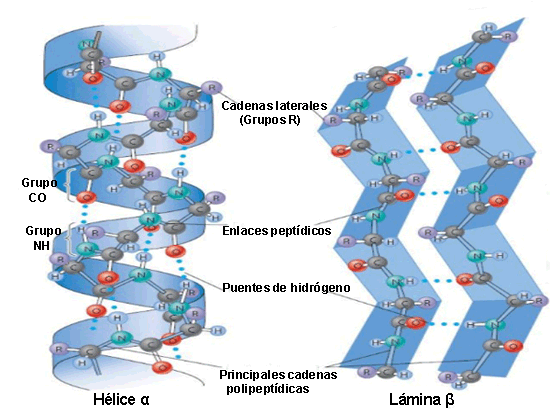
Alfa hélice, en la que la estructura primaria se enrolla sobre si misma en forma de espiral, mediante un giro hacia la derecha (Dextrógiro), hay 3.6 aminoácidos por vuelta y cada aminoácido se encuentra girado 100º con respecto al anterior. Esta estructura se mantiene estable gracias a la formación de enlaces de hidrógeno intracatenarios, que se forman entre el grupo amino de un aminoácido y el carbonilo del cuarto aminoácido con respecto a el.
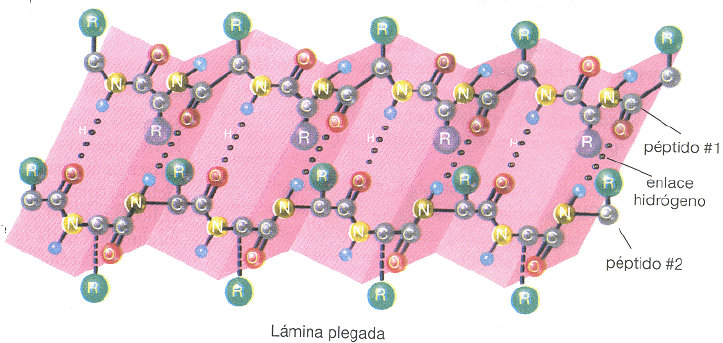
Conformación beta, se conserva la estructura primaria en zig zag. Presenta enlaces de hidrógeno intercatenarios dando una gran estabilidad. En esta estructura las cadenas laterales de los aminoácidos se sitúan de forma alternante a la derecha y a la izquierda del esqueleto de la cadena. Cuando las estructuras beta tienen el mismo sentido, la hoja beta resultante es paralela, por el contrario, si las estructuras beta tienen sentidos opuestos, la hoja plegada resultante es antiparalela.
Hélice de colágeno, estructura particularmente rígida compuesta por prolina y por hidroxiprolina, parecida a la alfa-hélice pero con giro de tipo levogiro. Además hay 3 aminoácidos por vuelta, por lo que es más alargada. El colágeno está formado por 3 hélices, unidas mediante enlaces covalentes del tipo enlace peptídico y enlaces débiles del tipo enlaces de hidrógeno.
Estructura terciaria: disposición espacial adoptada por la estructura secundaria, cuando se pliega sobre si misma, dando lugar a una estructura de conformación globular. Esta se mantiene estable y unida mediante una serie de enlaces débiles (enlaces de hidrógeno, atracciones electrostáticas, atracciones hidrofóbicas y las fuerzas de Van Der Waals) y los puentes de disulfuro, enlace fuerte. Dependiendo de la solubilidad podemos diferenciar 2 tipos de proteínas:
Proteínas globulares, que son proteínas casi esféricas, solubles en H2O y con función enzimática, transportadora, hormonal y de defensa. (ej: la mioglobina, transportadora de O2)
Proteínas fibrosas, cadenas peptídicas que forman moléculas alargadas, solubles en agua y en disoluciones salinas por presentar un predominio de cadenas R hidrófobas. Desempeñan, fundamentalmente, funciones estructurales. (ej: el colágeno)
Estructura cuaternaria: formada por la unión de varias cadenas polipeptídicas con estructura terciaria, denominadas protómeros, que se mantienen unidos mediante enlaces débiles, y en ocasiones por enlaces del tipo disulfuro. Existen varios tipos según los protómeros que se unen: dímeros, trímeros, tetrámeros o pentámeros.
Además en clase también realizamos un esquema explicativo de los distintos niveles estructurales de las proteínas, por parejas:

Podemos clasificar las proteínas en:
Holoproteínas: las cuales presentan únicamente aminoácidos. Entre este grupo se subdividen dos tipos de proteínas: las globulares y las fibrosas.
Heteroproteínas: Además de presentar aminoácidos, también presentan otras moléculas, denominado grupo prostético. Estas se dividen a su vez en cromoproteínas, nucleoproteínas, glucoproteínas, fosfoproteínas y lipoproteínas.
Entre las propiedades de las proteínas se distinguen:
Solubilidad: los radicales polares de la proteína forman enlaces de hidrógeno. De manera que se forma una envoltura acuosa alrededor de la proteína que impide la unión de otras proteínas y por tanto su precipitación. (excepto las proteínas fibrosas)
Desnaturalización: pérdida de la estructura compleja, por rotura de enlaces, lo que lleva a una estructura primaria que terminará adquiriendo forma fibrosa, por lo que precipitará. Esto se puede dar por diferentes motivos como: la polaridad del disolvente, pH, urea, temperatura o incluso la agitación. La desnaturalización puede ser reversible, produciéndose una renaturalización donde las proteínas pueden replegarse y adoptar nuevamente su conformación nativa, recuperando la actividad biológica perdida cuando la desnaturalización no ha afectado a los enlaces peptídicos.
Especificad: puede ser de función o de especie. La de función depende de la posición que ocupan determinados aminoácidos de los que constituyen su secuencia lineal. Esta secuencia condiciona la estructura cuaternaria, responsable de la función específica de las proteínas. Una pequeña variación en la secuencia de aminoácidos puede suponer la pérdida de la función.Por otro lado, Existen proteínas exclusivas de cada especie. Las proteínas que desempeñan la misma función en distintas especies suelen tener una composición y estructura similares y se denominan proteínas homólogas.
Capacidad amortiguadora: debido a que tienen carácter anfótero, puede regular la concentración de pH debido a que alcanzan ese punto isoeléctrico, así amortiguan las variaciones de pH del medio en el que se encuentran.
Por último, las proteínas tienen función de reserva, transportadora, contráctil, protectora o defensiva, transducción de señales químicas, hormonal, estructural, enzimática, homeostática y de reconocimiento de enlaces químicos.
Para tener toda esta información de manera visual y esquemática, el esquema general del tema:

ACTIVIDADES PROTEÍNAS
1. Con respecto a las proteínas:
a) Enumerar los cuatro niveles de estructura de las proteínas.
Los cuatro niveles de estructura de la proteína son estructura primaria (secuencia lineal), estructura secundaria, disposición espacial de la estructura primaria que se divide en alfa-hélice, conformación beta y hélice de colágeno; estructura terciaria (disposición espacial de la estructura secundaria), entre ella se distinguen las proteínas globulares y filamentosas, y por último, estructura cuaternaria, formada por cadenas polipeptídicas, que se llaman protómeros, con estructura terciaria idéntica o no.
b) Indicar qué tipos de enlaces intervienen en la estabilización de cada uno de estos niveles estructurales.
En la estructura primaria encontramos enlaces covalentes que unen los distintos radicales de los aminoácidos, y el enlace peptídico, entre el grupo carboxilo (-COOH) de un aminoácido, con el amino (-NH2) del siguiente. Este tipo de enlace está presente en todas las estructuras de las proteínas.
En la estructura secundaria se establecen, además de enlaces peptídicos entre los aminoácidos, si es alfa-hélice y de la hélice de colágeno, se forman enlaces de hidrógeno intracatenarios entre el grupo amino de un aminoácido y el carbonilo (-C=O) de el cuarto aminoácido con respecto a él. Y en el caso de la conformación beta se forman enlaces de hidrógeno intercatenarios.
En la estructura terciaria se forman un gran número de enlaces débiles como los enlaces por puentes de hidrógeno, atracciones electrostáticas, atracciones hidrofóbicas (uniones de radicales hidrocarbonados de cadena no muy larga) y fuerzas de Van Der Waals.Y por otro lado también se forma un enlace fuerte del tipo disulfuro, cuando los grupos --tiol "-SH" de las cisteínas se encuentran e interaccionan.
Por último en la estructura cuaternaria se forman enlaces débiles (no covalentes) y enlaces covalentes del tipo disulfuro (fuerte) para unir las distintas cadenas polipeptídicas (protómeros).
c) Especificar la estructura que caracteriza a las α-queratinas.
La α-queratina se caracteriza por presentar una estructura secundaria de tipo alfa-hélice y ser una proteína filamentosa. Cuando decimos que es α-hélice, decimos que su estructura se forma al enrollarse la estructura primaria sobre sí misma con un giro dextrógiro gracias a los puentes de hidrógeno, dando lugar a una hélice con unos 3,6 aminoácidos por vuelta. Por otro lado, diremos que es filamentosa porque no se llega a formar estructura terciaria, manteniendo su estructura secundaria en forma alargada y confiriéndole propiedades características como la insolubilidad en agua, y funciones como la esquelética.
d) Describir dos propiedades generales de las proteínas.
Dos propiedades podrían ser la solubilidad y la capacidad amortiguadora. La solubilidad de las proteínas se debe a que los radicales polares localizados en la superficie externa de las proteínas establecen enlaces de hidrógeno con las moléculas de agua que les rodea, la unión con la molécula de agua va impedir a esta unirse a otras proteínas y por tanto su precipitación. Las proteínas globulares son solubles en agua, mientras que las filamentosas no lo son.
Si hablamos de la especificidad, hablaremos del carácter anfótero de las proteínas, esta propiedad es la que la diferencia de las demás biomoléculas orgánicas. Quiere decir que los aminoácidos tienen la capacidad de comportarse como ácido, en la que tienen una alta concentración de protones, por lo que necesitan liberar, y como base, tienen baja concentración de protones, por lo que tiene que captarlos. Gracias a ello regulan el pH del medio, lo que se denomina efecto amortiguador o efecto tampón.
e) Describir dos funciones de las proteínas. Indica ejemplo.
Reserva: No solo se trata de una reserva energética, sino también de una reserva de aminoácidos que pueden ser utilizados como nutrientes. De esa manera podemos encontrar ejemplos como la caseína (que es una fosfoproteína que se encuentra en la leche), la ovoalbúmina (que es una proteína globular, que se encuentra en la clara del huevo) o la zeína (que se encuentra en el maíz).
Enzimáticas: Las proteínas son catalizadores bioquímicos que hacen que las reacciones químicas se puedan dar a mayor velocidad o incluso que se puedan dar. Ejemplos de este tipo de proteínas serían las lipasas, hidrolasas, deshidrogenasas, maltasas, isomerasas, polimerasas, sintetasas,....
f) Defina el proceso de desnaturalización. ¿Qué tipo de enlaces no se ven afectados?
El proceso de desnaturalización es la pérdida de la estructura cuaternaria, terciaria, y en ocasiones secundaria de la proteína como consecuencia de los cambios del medio externo, como las variaciones de temperatura o de pH, por consiguiente, pierden también algunas de sus funciones. Como los enlaces peptídicos no se ven afectados, si las condiciones del medio vuelven a ser óptimas, la proteína recobra su estructura en un proceso denominado renaturalización.
g) ¿Qué significa que un aminoácido es anfótero?
Un aminoácido es anfótero al tener la capacidad de regular el pH, captando o cediendo H+, y se produce gracias a que alcanza el punto isoeléctrico, donde el pH es neutro (7). Un aminoácido se pone en contacto con el H2O, el grupo (-NH2) tiende a coger un protón quedando como (-NH3+). Por otro lado, el grupo carboxilo (-COOH) pierde un protón quedando como (-COO-). De esa manera el aminoácido queda con una parte cargada positivamente y otra negativamente. Cuando el medio es ácido, el aminoácido va a actuar como base y va a captar H+ del medio. Sin embargo, si el medio es básico, este va a actuar como ácido cediendo H+ al medio.
Por ello se dice que las proteínas tienen la propiedad de capacidad amortiguadora, participando, además, en la homeostasis.
ACTIVIDADES PAU
1. En la siguiente reacción dos monómeros reaccionan para formar un dímero:
a) ¿Qué moléculas son estos monómeros?¿En que tipo de macromoléculas se encuentra esta unión?
Estos monómeros son aminoácidos, ya que se puede ver que están formados por un carbono unido a cuatro radicales, que mediante enlaces peptídicos dan lugar a una proteína.
b) ¿Cómo se denomina el enlace que se forma entre estos monómeros? ¿Cuales son las características de este enlace?
Estos dos monómeros o aminoácidos se unen entre sí mediante enlaces covalentes denominados enlaces peptídicos. El enlace tiene lugar entre el grupo carboxilo de un aminoácido y el grupo amino del siguiente aminoácido, perdiéndose una molécula de agua. Debido a la presencia del doble enlace, la proteína no puede girar libremente ya que la hace rígida. Los cuatro átomos que forman parte del enlace peptídico y los dos átomos de carbono a los que se unen se encuentran en un plano. Los únicos enlaces que pueden girar y no del todo son los formados por C-C y N-C.
c) Cita dos ejemplos de esta macromolécula e indica su función.
Trombina: posee función protectora, son proteínas sanguíneas de vertebrados que intervienen en la coagulación de la sangre, impidiendo su salida del sistema circulatorio.
Hidrolasa: tiene función enzimática, son enzimas catalizadoras que aumentan la velocidad de las reacciones bioquímicas.
2. Explica el tipo de interacciones o enlaces que estabilizan la estructura secundaria y terciaria de las proteínas.
Las proteínas de estructura secundaria se mantienen estables gracias a los enlaces intercatenarios e intracatenarios, dependiendo de su es alfa hélice, o conformación beta.
Las proteínas de estructura terciaria se mantienen estables gracias a las uniones de los radicales de aminoácidos que están muy separados entre sí, estas uniones pueden ser: enlaces de hidrógeno entre grupos peptídicos, interacciones iónicas, atracciones hidrofóbicas, fuerzas de Van der Waals y puentes de disulfuro.
3. ¿Qué significa que los aminoácidos son anfóteros? ¿A qué se debe esta característica?
Significa que puede tener un carácter ácido y actuar liberando protones o básico y actuar captan protones en relación a cómo sea el medio en el que se encuentran, igualando el pH. Por eso se dice que actúan como disoluciones tampón o amortiguadoras, participando así en la homeostasis. Esta propiedad explica su función homeostática. Esto se debe a que en disolución acuosa forman iones dipolares o híbridos, que tienen el mismo número de cargas positivas que negativas. El pH al que se forman los iones híbridos se llama punto isoeléctrico.
4. En relación a la estructura de las proteínas:
a) Explica qué es la estructura terciaria y que tipo de fuerzas o interacciones participan en el mantenimiento de la estructura terciaria. ¿Existe un nivel superior a la estructura terciaria? En caso afirmativo, indica en qué ocasiones se forma.
La estructura terciaria, es la disposición de la estructura secundaria cuando se pliega sobre si misma. Presentan una estructura estable gracias a las uniones entre radicales de aminoácidos que están muy separados entre sí. Estas uniones pueden ser: enlaces de hidrógeno entre grupos peptídicos, interacciones iónicas, atracciones hidrofóbicas, fuerzas de Van der Waals y puentes de disulfuro.
Si existe otro nivel superior a la estructura terciaria, que es la estructura cuaternaria la cual se forma por la unión de dos o más cadenas polipeptídicas.
b) Al medir la actividad de la enzima hexoquinasa se produjo, accidentalmente, un aumento de la temperatura hasta los 80 ºC. En esas condiciones no se detectó la actividad de la enzima. Explica qué proceso justifica esta observación.
Podemos justificar que el hecho de que la enzima no ha llegado a activarse haya sido porque la proteína se ha desnaturalizado debido a la alta temperatura en la que se encontraba el medio. Como consecuencia se pierden las estructuras secundaria, terciaria y cuaternaria y con ello pierdes su actividad biológica.
.png)














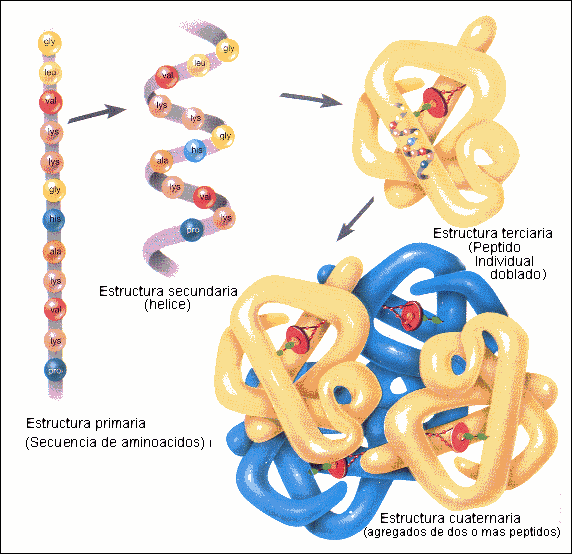







Comentarios